![]()
Andere namen
Ethylalcohol
Spiritus of brandspiritus
Alcohol is in het dagelijkse spraakgebruik de naam voor ethanol
Molaire
massa |
46,0
g/mol |
Smeltpunt |
-
114 °C |
Kookpunt |
78 °C |
Dichtheid |
0,79
g/mL |
Oplosbaarheid in water |
In alle verhoudingen mengbaar met water |
Bij het mengen van gelijke volumes ethanol en water treedt er een volumecontractie op van ca. 4 %.
Ethanol vormt met water een azeotroop mengsel dat bestaat uit 96% ethanol en 4% water.
(Een azeotroop is een mengsel van twee of meer componenten waarvan de dampfase dezelfde samenstelling heeft als de vloeistoffase. Verdere scheiding via destillatie wordt alzo onmogelijk).
De zuivere alcohol zoals die in de handel wordt verkocht bevat dus 96% ethanol. Wil men 100% zuivere alcohol bekomen (absolute alcohol) dan moet de resterende 4% water verwijderd worden door bijv. een wateropslorpende stof zoals watervrij kopersulfaat of ongebluste kalk e.d. toe te voegen en dan af te destilleren.
Ethanol is giftig en boven een bepaalde dosis (5 %0 voor de meesten) dodelijk. Elk jaar sterven er mensen die zich letterlijk dood drinken. Men kan ook zoveel drinken dat men in een coma geraakt. We denken hierbij aan een treurig verschijnsel bij sommige jongeren n.l. het “comadrinken”.
Bereiding
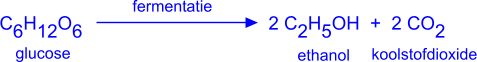
1. Fermentatie
De grootste hoeveelheden ethanol worden bereid door alcoholische gisting (fermentatie) van glucose.
De keuze van de bron voor glucose is ruim: glucose uit druiven (druivensuiker), aardappelzetmeel, bietsuiker, roggezetmeel, rijstzetmeel, maďszetmeel, rietsuiker e.a.
Di- en polysachariden worden door enzymen, bij relatief lage temperatuur, eerst omgezet tot er gistbare glucose ontstaat. Daaruit ontstaan door fermentatie ethanol en koolstofdioxide.
De gisting houdt spontaan op als er 14 vol-% ethanol gevormd is (giftig gehalte voor de gistcellen).
2. Elektrofiele additie van water aan etheen
In sommige landen (Frankrijk bijvoorbeeld) levert de alcoholische gisting de nodige hoeveelheid ethanol voor de industrie. In andere industrielanden wordt 90% van de productie door synthese verkregen. Men gaat uit van etheen dat afkomstig is van cokesovengas of van kraakgassen.
Dit etheen moet gehydrateerd worden:
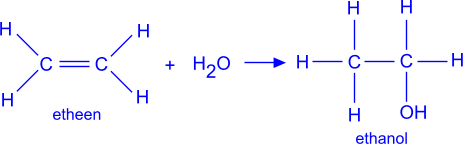
3. Nucleofiele additie van een halogeenatoom in een halogeenalkaan door een OH-groep
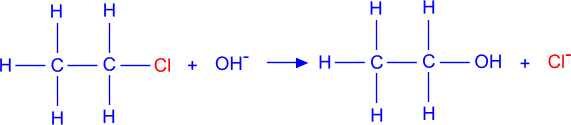
 2 CO2 + 3 H2O
2 CO2 + 3 H2O