Het element koolstof
Het element koolstof
bevindt zich in groep IVa (14) van het PS. Het vormt bij n.o. een vast niet-metaal
met vier allotrope vormen n.l. één amorfe en drie kristallijne
(grafiet, diamant en fullereen).
Koolstof werd al in de prehistorische oudheid ontdekt en gebruikt in de
vorm van houtskool, dat bereid werd door organisch materiaal (meestal hout)
te verhitten in een zuurstofarme omgeving. Het Engelse carbon is dan ook
afgeleid van het Latijn, waar carbo houtskool betekent.
Alhoewel koolstof slechts voor ca. 0,1 massa% op aarde voorkomt, speelt
het toch een zeer belangrijke rol in de natuur, zowel in de minerale als
in de levende materie. Het is na zuurstof het element dat het meest vertegenwoordigd
is in de levende wezens. Onder de vorm van calciet, dolomiet, marmer en
andere kalkgesteenten vindt men het zeer verspreid in steengroeven, grotten
en rotsmassieven. Als overblijfsel van vroeger levende organismen vindt
men veel fossiele koolstof in steenkool, bruinkool en turf. Aardolie of
ruwe petroleum bestaat uit verbindingen van koolstof met waterstof(koolwaterstoffen).
De lucht bevat gemiddeld 0,03 volume% CO2.
Diamant
Diamant is een
van de vier natuurlijke allotrope verschijningsvormen van koolstof (de meest
voorkomende is grafiet). Diamant is in zuivere toestand een kleurloze kristallijne
stof met r = 3510 kg/m3.
Door verontreinigingen kan het soms geel of zwart gekleurd zijn (carbonado).
Het heeft een sterk lichtbrekend vermogen, eigenschap waaraan een geslepen
diamant zijn schittering dankt. De diamant ontleent zijn naam aan het Griekse
adamas, "ontembaar" of "onoverwinnelijk", verwijzend naar
zijn hardheid.
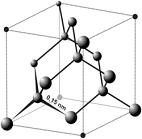
| In diamant
is elk koolstofatoom covalent gebonden met vier andere koolstof atomen,
die de toppen van een regelmatige tetraëder innemen. Hun onderlinge
afstand bedraagt 154 pm. Elk dergelijk koolstofatoom is op zijn beurt
tetraëdrisch met vier andere verbonden, zodat een reuzemolecule ontstaat,
die buitengewoon hard is. Diamant is de hardste van alle stoffen, het
is dan ook het ijkpunt voor hardheid 10 op de hardheidsschaal van Mohs. |
|
Diamant is niet
geleidend voor de elektrische stroom.
Diamant wordt noch door zuren, HF inbegrepen, noch door basen aangetast. Bij
gloeihitte verbrandt het met zuurstof tot CO2.
Uit dit enige verbrandingsproduct blijkt dat diamant enkel uit koolstof bestaat.
Diamant is een transparant kristal met een brekingsindex van 2,417. In juwelen
wordt zo het (zon)licht mooi gebroken en weerkaatst. Bovendien wordt het gepolijste
glanzende oppervlak van de diamantsteen niet mat omdat het materiaal zo hard
is.
Grafiet is een zwarte tot zwart-grijze
kristallijne stof, met doffe metaalglans, zacht en vettig aanvoelend met r
= 2250 kg/m3. Men vindt het in de natuur
(Siberië) maar het kan ook kunstmatig verkregen worden, door amorfe koolstof
in de elektrische oven, bij luchtafsluiting, tot zeer hoge temperatuur te
brengen. (Acheson-grafiet)
 |
 Acheson
Acheson |
Grafiet bestaat uit bladvormige
reuzemoleculen op 340 pm van elkaar, samengehouden door londonkrachten. In
de bladen zelf is elk koolstof atoom covalent met drie andere koolstofatomen
gebonden. Hun onderlinge afstand bedraagt 142 pm. Daar koolstof vier valentie-elektronen
heeft, is elk koolstof atoom met de drie buren enkelvoudig gebonden. Elk koolstofatoom
heeft nog één elektron in een p-orbitaal die loodrecht staat
op vlak waarin zich de bladvormige reuzemolecule bevindt. Vermits dus alle
p-orbitalen evenwijdig zijn kunnen de zich daarin bevindende elektronen vrij
bewegen in een soort reusachtige molecuulorbitaal over geheel de molecule.
Zijn zachtheid dankt grafiet aan de zwakke bindingen tussen de bladstructuren,
waardoor de bladen gemakkelijk over elkaar kunnen glijden. Daarom is het ook
een goed smeermiddel. In tegenstelling tot diamant geleidt grafiet de elektrische
stroom goed. Dat geleidingsvermogen is het gevolg van de beweeglijke elektronen
in de hoger besproken molecuulorbitalen.
Grafiet wordt gebruikt voor
het maken van potloden, smeltkroezen, elektroden materiaal, koolborstels voor
dynamo’s en motoren, om gietvormen geleidend te maken in de galvanoplastie,
als smeermiddel voor bladveren, om ijzeren toestellen tegen roesten te beschermen.

![]()